Este es el video final en cual dice nuestras opiniones y trabajos
https://www.youtube.com/watch?v=qNyjPIdMyBg
Química
martes, 22 de noviembre de 2016
miércoles, 16 de noviembre de 2016
Introducción
1. ¿Cuál era el contexto histórico, en los niveles local, nacional e internacional, en el que se propuso el modelo atómico en cuestión (cuándo, dónde y quién)?
En 1911, Ernest Rutherford presentó un modelo que con el tiempo se convertiría en referencia obligada en la historia del desarrollo de la estructura atómica. Sin embargo, en su época no fue recibido con entusiasmo, entre otras razones, porque era más un modelo para explicar la dispersión de partículas alfa que uno atómico. Evidencias experimentales resultado de los trabajos de Geiger y Marsden ayudaron a consolidar la idea de que el átomo estaba provisto de un núcleo masivo con carga positiva.
2. ¿Cuáles son las principales características del modelo y en que postulados se fundamenta?
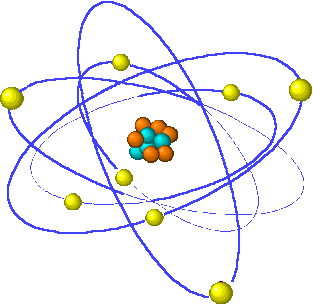
En 1911, Rutherford introduce el modelo planetario, cuyas características son:
- Un núcleo central, que contiene los protones y neutrones (y por tanto allí se concentra toda la carga positiva y casi toda la masa del átomo).
- Una corteza, formada por los electrones, que giran alrededor del núcleo en órbitas circulares, de forma similar a como los planetas giran alrededor del Sol.
- El átomo está prácticamente hueco.
Postulados en el que se fundamenta:
- Los átomos poseen el mismo número de protones y electrones, por tanto son entidades neutras.
- El núcleo atómico está formado por partículas de carga positiva y gran masa (protones).
- El núcleo, además, debe estar compuesto por otras partículas con carga neutra para explicar la elevada masa del átomo (superior a lo esperado teniendo en cuenta solo el número de protones).
- Los electrones giran sobre el núcleo compensando la atracción electrostática (que produce la diferencia de cargas respecto al núcleo) con su fuerza centrífuga.
3. ¿Cuáles fueron las partículas subatómicas descubiertas (masa, carga, ubicación)?
| Partícula | Símbolo | Carga Eléctrica (C) | Masa (kg) | Ubicación en el átomo |
| Electrón | e- | -1.6·10-19 | 9.11·10-31 | En la corteza electrónica, alrededor del núcleo |
| Protón | p+ | +1.6·10-19 | 1.67·10-27 | En el núcleo |
| Neutrón | n | 0 | 1.67·10-27 | En el núcleo |

4. De acuerdo con el modelo, ¿Cómo está formado el átomo?
Según Rutherford, el átomo estaba constituido por dos partes: Núcleo y Corteza.
El núcleo es la parte central, de tamaño muy pequeño, donde se encuentra toda la carga positiva y, prácticamente, toda la masa del átomo. Esta carga positiva del núcleo es la responsable de la desviación de las partículas alfa (también con carga positiva).
Mientras que en la corteza se encuentran los electrones con masa muy pequeña y carga negativa que se mueven alrededor del núcleo, ligadas por la atracción eléctrica entre cargas opuestas.
5. ¿Qué aciertos y errores tiene el modelo atómico de Rutherford?
Errores- No considera la pérdida de energía de los electrones.
- Contradice la teoría electromagnética.
- No logra explicar ningún espectro atómico.
Aciertos:
- Estableció la diferencia entre corteza electrónica y núcleo, algo que él llamo "concentración de carga positiva". Rutherford también predijo la existencia del neutrón.
- Fue capaz de explicar la tabla periódica y las variaciones periódicas de algunas propiedades de los elementos.
- Su modelo era coherente con la existencia de iones.
- Logró explicar la existencia de isótopos y así poder definir de forma más precisa una escala de masas atómicas.
6. ¿Como se sabe que el átomo esta construido de esa manera?
En 1886, Eugen Goldstein descubrió que si se le hacían agujeros al ánodo de un tubo de rayos catódico era posible ver otras emanaciones que se dirigían desde el cátodo hacia el ánodo, cuando se hacía pasar una corriente eléctrica. Descubrió que estos rayos (a los que llamó rayos canales) tenían carga positiva y que su masa dependía del gas que estuviera en el tubo. A éstas cargas se les denominó protones. Como estas partículas están cargadas con el mismo signo, debiesen repelerse, pero están todas situadas en el núcleo, entonces ¿cómo es esto posible? Rutherford pensó que debiese existir otra partícula que sirviera de "pegamento" que mantuviera estable el núcleo.
Al inicio de la década de 1930, James Chadwick, quien fuese alumno de Rutherford, descubrió la presencia de una partícula sin carga, de masa aproximadamente igual a la del protón, la cúal fue llamada neutrón, comprobando la hipótesis de su profesor sobre la existencia de dicha partícula.
7. ¿Qué importancia y aplicaciones observas en los elementos radioactivos?
Se han elaborado radio vacunas para combatir enfermedades parasitarias del ganado y que afectan la producción pecuaria en general. Los animales sometidos al tratamiento soportan durante un período más prolongado el peligro de reinfección siempre latente en su medio natural.
Gracias al uso de las técnicas nucleares es posible desarrollar diversos estudios relacionados con recursos hídricos. En estudios de aguas superficiales es posible caracterizar y medir las corrientes de aguas lluvias y de nieve; caudales de ríos, fugas en embalses, lagos y canales y la dinámica de lagos y depósitos.
8. ¿Han tenido contacto con los elementos químicos y con elementos radiactivos en su vida personal y social?
En el diagnóstico se utilizan radiofármacos para diversos estudios de:- Tiroides.
- Hígado.
- Riñón.
- Metabolismo.
- Circulación sanguínea.
- Corazón.
- Pulmón.
- Trato gastrointestinales
En terapia médica con las técnicas nucleares se puede combatir ciertos tipos de cáncer. Con frecuencia se utilizan tratamientos en base a irradiaciones con rayos gamma provenientes de fuentes de Cobalto-60, así como también, esferas internas radiactivas, agujas e hilos de Cobalto radiactivo. Combinando el tratamiento con una adecuada y prematura detección del cáncer, se obtienen terapias con exitosos resultados.
Si,mucho
9. ¿Ha sido favorable?
Si,mucho
Suscribirse a:
Comentarios (Atom)


